Tabel periodik merupakan salah satu tabel yang sangat dibutuhkan dalam ilmu kimia. Dalam ilmu kimia, sangat erat dengan unsur kimia yang merupakan zat kimia yang dapat diubah menjadi zat yang kecil.
Unsur kimia juga dapat diartikan sebagai zat yang tidak bisa dibagi dengan menggunakan metode kimia yang biasa digunakan.
Dalam ilmu kimia terdapat 118 unsur yang dapat dilihat melalui tabel periodik yang diakui secara internasional. namun dalam hal ini, masih terdapat kemungkinan adanya penemuan baru tentang unsur-unsur kimia tersebut.
Konten
Pengertian Tabel Periodik
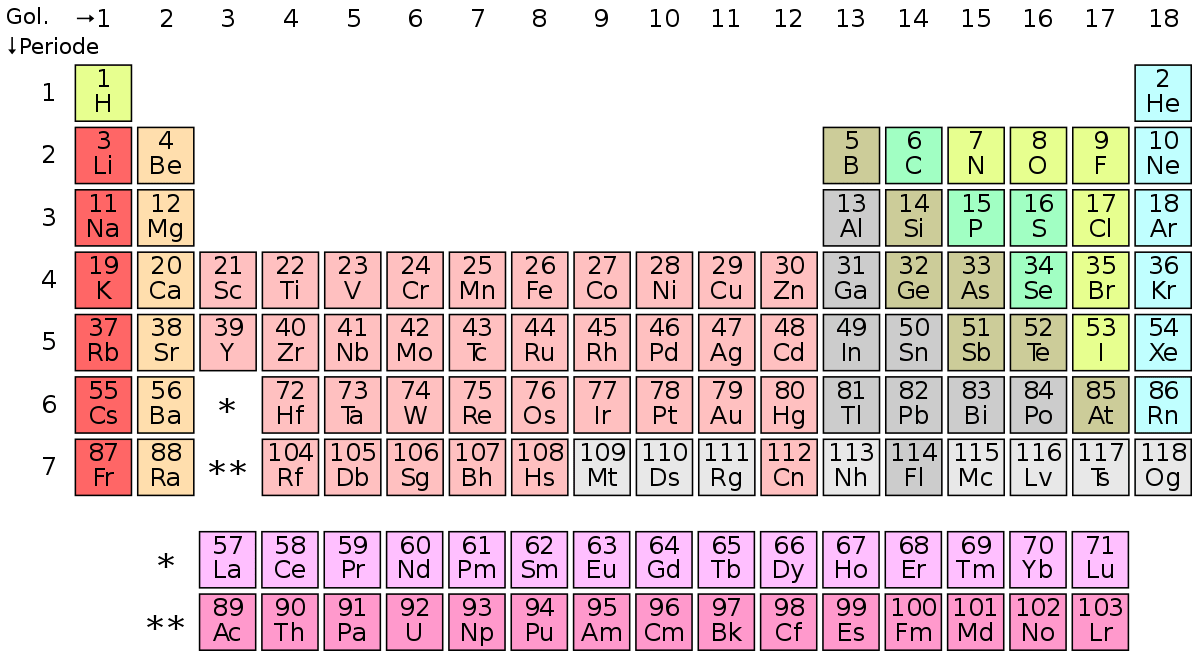
Tabel periodik merupakan tabel yang menampilkan berbagai unsur kimia. Unsur-unsur tersebut disusun berdasarkan nomor atom yaitu jumlah proton yang terdapat di dalam inti atom, keberulangan sifat kimia dan konfigurasi elektron.
Tabel periodik dibagi menjadi empat blok yaitu blok –s, -d, -p dan –f, namun pada umumnya dibagi menjadi satu periode atau garis. Pada tabel sebelah kiri menampilkan unsur-unsur yang bersifat logam, dan sifat non logam pada sebelah kanan.
Ciri-ciri Unsur Logam
- Bersifat padat, yaitu dapat dibentuk atau ditempa
- Unsur bersifat konduktor, yaitu dapat menghantarkan panas
- Memiliki kerapatan yang tinggi.
Ciri-ciri Unsur Non Logam
- Bersifat rapuh
- Unsur-unsur bersifat isolator
- Memiliki kerapatan unsur yang rendah.
Keterangan Tabel Periodik Unsur
Berikut ini merupakan keterangan unsur kimia secara lengkap di tabel periodik.
| No Atom | Unsur Kimia | Simbol |
|---|---|---|
| 1. | Hidrogen | H |
| 2. | Helium | He |
| 3. | Beryllium | Be |
| 4. | Boron | B |
| 5. | Lithium | Li |
| 6. | Carbon | C |
| 7. | Oxygen | O |
| 8. | Nitrogen | N |
| 9. | Fluorine | F |
| 10. | Sodium | Na |
| 11. | Neon | Ne |
| 12. | Magnesium | Mg |
| 13. | Silicon | Si |
| 14. | Alumunium | AL |
| 15. | Phosphorus | P |
| 16. | Sulfur | S |
| 17. | Argon | Ar |
| 18. | Chlorine | Cl |
| 19. | Potassium | K |
| 20. | Calcium | Ca |
| 21 | Scandium | Sc |
| 22. | vanadium | V |
| 23. | Titanium | T |
| 24. | Chromium | Cr |
| 25. | Manganese | Mn |
| 26. | Cobalt | Co |
| 27. | Iron | Fe |
| 28. | nickel | Ni |
| 29. | Zinc | Zn |
| 30. | Copper | Cu |
| 31. | Gallium | Ga |
| 32. | Germanium | Ge |
| 33. | Gallium | Ga |
| 34. | Arsenic | As |
| 35. | Selenium | Se |
| 36. | Bromine | Br |
| 37. | Rubidium | Rb |
| 38. | Strontium | Sr |
| 39. | Yttrium | Y |
| 40. | Zorconium | Zr |
| 41. | niobium | Nb |
| 42 | molybdenum | Mo |
| 43 | technetium | Tc |
| 44 | ruthenium | Ru |
| 45 | rhodium | Rh |
| 46 | palladium | Pd |
| 47 | silver | Ag |
| 48 | cadmium | Cd |
| 49. | Tin | Sn |
| 50. | Indim | In |
| 51 | antimony | Sb |
| 52 | tellurium | Te |
| 53 | iodine | I |
| 54 | xenon | Xe |
| 55 | cesium | Cs |
| 56. | lanthanum | La |
| 57. | Barium | Ba |
| 58 | cerium | Ce |
| 59 | praseodymium | Pr |
| 60 | neodymium | Nd |
| 61 | promethium | Pm |
| 62 | samarium | Sm |
| 63. | Gadolinium | Gd |
| 64. | Europium | Eu |
| 65 | terbium | Tb |
| 66 | dysprosium | Dy |
| 67 | holmium | Ho |
| 68 | erbium | Er |
| 69 | thulium | Tm |
| 70 | ytterbium | Yb |
| 71. | Hafnium | Hf |
| 72. | Lutetium | Lu |
| 73 | tantalum | Ta |
| 74 | tungsten | W |
| 75 | rhenium | Re |
| 76 | osmium | Os |
| 77. | Platinum | Ir |
| 78. | Iridium | Ir |
| 79 | gold | Au |
| 80 | mercury | Hg |
| 81 | thallium | Tl |
| 82 | lead | Pb |
| 83. | Polonium | Po |
| 84. | Bismuth | Bi |
| 85 | astatine | At |
| 86 | radon | Rn |
| 87 | francium | Fr |
| 88 | radium | Ra |
| 89. | Thorium | Th |
| 90. | Actinium | Ac |
| 91 | protactinium | Pa |
| 92 | uranium | U |
| 93 | neptunium | Np |
| 94 | plutonium | Pu |
| 95. | Curium | Cm |
| 96. | Americium | Am |
| 97 | berkelium | Bk |
| 98 | californium | Cf |
| 99 | einsteinium | Es |
| 100 | fermium | Fm |
| 101. | Nobelium | No |
| 102. | Mendelevium | Md |
| 103 | lawrencium | Lr |
| 104 | rutherfordium | Rf |
| 105 | dubnium | Db |
| 106 | seaborgium | Sg |
| 107. | Hassium | Hs |
| 108. | Bohrium | Bh |
| 109 | meitnerium | Mt |
| 110 | Darmstadtium | Ds |
| 111 | Roentgenium | Rg |
| 112 | Copernicium | Cn |
| 113. | Ununquadium | Uuq |
| 114. | Ununtrium | Uut |
| 115 | Ununpentium | Uup |
| 116 | Ununhexium | Uuh |
| 117 | Ununseptium | Uus |
| 118 | Ununoctium | Uuo |
Unsur Sistem Periodik
- Golongan IA (Logam Alkali), termasuk logam lunak seperti karet penghapus dan bisa diiris menggunakan pisau serta memiliki massa jenis yang ringan.
- Golongan IIA (logam alkali tanah), termasuk logam aktif dan hanya dapat dibakar di udara saat dipanaskan. Biasanya digunakan sebagai obat maag untuk obat kesehatan.
- Golongan VIIA (Halogen), merupakan kelompok unsur non logam yang reaktif.
- Golongan VIIIA (Gas Mulia), unsur kimia yang sulit bereaksi dengan unsur lain.
- Golongan B (Unsur Transisi), unsur yang ada pada bagian tengah sistem periodik, yaitu golongan tambahan atau golongan B.
Sifat Periodik Unsur
Sifat periodik unsur merupakan sifat yang memiliki hubungan dengan letak unsur pada sistem periodik. Sifat tersebut berulang dan berubah secara periodik sesuai dengan perubahan nomor atom serta konfigurasi elektron.
1. Jari-jari Atom
Jari-jari atom adalah jarak elektron terluar ke dalam inti atom serta menunjukkan ukuran suatu atom. Jari-jari atom sulit diukur sehingga diukur dengan jarak inti antara dua atom yang berkaitan.
2. Energi ionisasi
Energi ionisasi merupakan energi yang digunakan untuk melepaskan elektron dari atom.
3. Keelektronegatifan
Keelektronegatifan merupakan kemampuan atom untuk menarik elektron dari atom lain.
4. Sifat Logam
Sifat logam dalam tabel periodik semakin kebawah semakin bertambah, sedangkan semakin kekanan semakin berkurang.
5. Kereaktifan
Reaktif adalah mudah bereaksi sehingga semakin kebawah logam semakin reaktif karena mudah melepaskan elektron.
6. Afinitas Elektron
Afinitas elektron adalah energi yang dibebaskan atau diserap jika suatu atom menerima elektron.
Penjelasan tentang tabel periodik diatas sangat membantu bagi anda yang sedang belajar tentang unsur-unsur kimia. Bagi anda yang belum mengetahui apa itu tabel periodik, semoga informasi diatas dapat bermanfaat.
Originally posted 2020-03-23 07:57:10.

